대웅제약(대표 전승호)은 SGLT-2 수용체 억제제 신약인 ‘이나보글리플로진’의 단독 사용과 메트포르민 병용 사용에 대한 임상 3상을 동시에 승인받아 개발을 가속화한다.
지난 9월 29일 대웅제약은 식품의약품안전처로부터 개발 중인 SGLT-2 당뇨병치료 신약 ‘이나보글리플로진’의 단독요법, 메트포르민 병용 요법 각각에 대한 유효성과 안전성을 평가하는 3상 임상시험을 동시에 승인받았다.
단독 사용 임상시험은 제 2형 당뇨병 환자 140여명 대상으로 서울대학교병원을 포함한 전국 30여개 대형병원에서 진행한다. 또한 메트포르민으로 혈당 조절이 불충분한 제 2형 당뇨병 환자 190여명 대상의 메트포르민 병용 사용 임상시험은 가톨릭대학교 서울성모병원을 포함한 전국 30여개 대형병원에서 진행할 예정이다.
'이나보글리플로진'은 콩팥에서 포도당의 재흡수에 관여하는 SGLT2수용체를 선택적으로 억제함으로써 포도당을 직접 소변으로 배출시키는 기전의 SGLT2 억제제로, 지난 9월 국제학술대회 2020 ICDM 에서 성공적인 임상 2상의 결과를 최초로 공개한 바 있다.
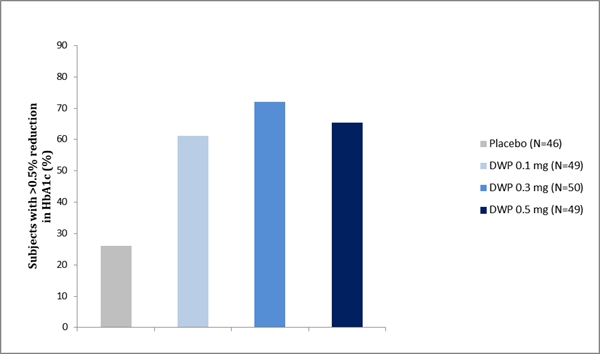
임상 2상시험 결과, 혈당 조절의 주요지표인 당화혈색소(HbA1c)의 12주 후 변화량은 위약 대비 약 0.9% 로, 이는 서양인들 대상으로 진행됐던 기존 SGLT2 억제제보다 약 30% 이상의 효과적인 감소를 확인한 결과이며, 향후 3상에서 더 큰 효과를 기대해 볼 수 있다.
또한 국제적인 당뇨병 조절목표인 당화혈색소 7.0% 이하로 도달한 환자 비율이 최대 61%에 달해 기존 SGLT-2 억제제보다 20% 이상 좋은 결과를 보였으며, 치료 전 대비 당화혈색소 0.5% 초과 감소한 환자비율은 동일 계열 약물의 40~60% 수준 대비 최대 72%를 기록해 탁월한 혈당감소 효과를 추가로 입증했다.
전승호 대표는 “대웅제약은 SGLT-2 당뇨병 신약인 ‘이나보글리플로진’이 계열 내 최고 신약으로 자리매김할 수 있도록 연구개발에 역량을 집중할 계획”이라며 “국내는 물론 글로벌 시장을 목표로 ‘이나보글리플로진’을 제2형 당뇨병 환자들에게 좋은 치료옵션으로 제공할 수 있도록 힘쓰겠다”고 말했다.
한편 SGLT-2 억제제 약물은 심부전 및 만성신부전약으로 영역을 확장하고 있어 이나보글리플로진 또한 당뇨병 치료제뿐만 아니라 비만, 심장, 신장 등 다양한 적응증 확대가 기대된다. 글로벌 주요국가 당뇨병 치료제 시장규모는 2019년 17조에서 2024년 약 20조원까지 성장할 것으로 예측되고 있다. 이나보글리플로진’은 2023년 국내 발매를 목표로 하고 있다.